Article contents
Calcium-Magnesium Exchange in Montmorillonite and Vermiculite
Published online by Cambridge University Press: 01 July 2024
Abstract
An experimentally determined Ca-Mg exchange isotherm of montmorillonite is reported. The selectivity coefficient of this exchange over a wide range of Mg saturation was calculated and found constant.
Standard free energies of exchange, thermodynamic equilibrium constants and activity coefficients of the exchangeable Ca and Mg ions in vermiculite and montmorillonite, were predicted from knowledge of the microstructure of these two clays, assuming that coulombic forces are the main ones playing a role in the interaction between the counterions and the charged clay surface. The standard free energies of exchange (ΔGCa°Mg = 238 cal/mole) predicted a preference for Ca in montmorillonite and a preference for Mg in vermiculite (ΔGCa°Mg = - 1665 cal/mole). The predicted thermodynamic equilibrium constants were compatible with the experimentally determined selectivity coefficients KsCaMg = 0·67 as compared with KsCaMg = 0·68 in montmorillonite, which remains constant over all the range of Mg saturation, and KCaMg = 16·7 as compared with KsCaMg = 13·9 in vermiculite at 95% Mg saturation. The activity coefficients of Ca and Mg counterions in montmorillonite were found to be 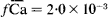 and
and 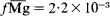 , respectively, and to remain constant. The activity coefficients of exchangeable Ca and Mg in vermiculite were found to be
, respectively, and to remain constant. The activity coefficients of exchangeable Ca and Mg in vermiculite were found to be 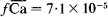 and
and 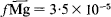 , respectively, at an equivalent fraction of unity. The activity coefficient of exchangeable Mg increased as the saturation with Mg decreased, and was found to be 1·7 × 10-3 in the range of the low Mg saturation.
, respectively, at an equivalent fraction of unity. The activity coefficient of exchangeable Mg increased as the saturation with Mg decreased, and was found to be 1·7 × 10-3 in the range of the low Mg saturation.
The microstructure, the isomorphic substitution and the surface charge density provided an understanding of the changes taking place in the activity coefficients of the counterions.
Résumé
On décrit dans ce travail un isotherme d’échange Ca-Mg déterminé expérimentalement avec une montmorillonite. Le coefficient de sélectivité de cet échange pour une gamme étendue de saturation en Mg a été calculé; il a été trouvé constant. Les énergies libres standard d’échange, les constantes d’équilibre thermodynamiques et les coefficients d’activité des ions Ca et Mg échangeables dans la vermiculite et la montmorillonite, ont été prédits d’après la connaissance de la microstructure de ces deux argiles, en supposant que les forces coulombiennes sont les principales à jouer un rôle dans l’interaction entre les cations compensateurs et la surface chargée de l’argile. Les énergies libres standard d’échange (ΔG°CaMg = 238 cal/mole) permettent de prévoir une préférence pour Ca dans le cas de la montmorillonite et une préférence pour Mg dans celui de la vermiculite (ΔG°CaMg = - 1665 cal/mole). Les constantes d’équilibre thermodynamiques que l’on peut prévoir sont compatibles avec les coefficients de sélectivité déterminés expérimentalement, KCaMg = 0,67 étant à comparer à KSCaMg = 0,68 pour la montmorillonite, ce coefficient restant constant sur toute la gamme de saturation en Mg, et KCaMg = 16,7 étant à comparer à KSCaMg = 13,9 pour la vermiculite à une saturation en Mg de 95%. Les coefficients d’activité des ions compensateurs Ca et Mg sont pour la montmorillonite respectivement fCa̅ = 2,0 × 10-3 et fMg̅ = 2,2 × 10-3; ils restent constants. Les coefficients d’activités des ions Ca et Mg échangeables dans la vermiculite sont respectivement fCa̅ = 7,1 × 10-5 et fMg̅ = 3,5 × 10-5, pour une fraction équivalente unitaire. Le coefficient d’activité du Mg échangeable augmente quand la saturation en Mg diminue, et il prend la valeur de 1,7 × 10-3 dans le domaine des basses saturations en Mg. La microstructure, les substitutions isomorphiques et la densité de charge superficielle permettent de comprendre les modifications qui apparaissent dans la valeur des coefficients d’activité des ions compensateurs.
Kurzreferat
Es wird über eine experimentell bestimmte Ca-Mg Austauschisotherme von Montmorillonit berichtet. Der Selektivitätskoeffizient dieses Austausches über einen weiten Bereich der Magnesium-Sättigung wurde berechnet und als konstant festgestellt. Standard freie Austauschenergien, thermodynamische Gleichgewichtskonstanten und Aktivitätskoeffizienten der austauschbaren Ca und Mg Ionen in Vermiculit und Montmorillonit wurden aus der Kenntnis des Mikrogefüges dieser beiden Tone vorausgesagt, unter der Annahme, dass die Coulomb-schen Kräfte die wesentliche Rolle bei der Wechselwirkung zwischen Gegenionen und der geladenen Tonoberfläche spielen. Die Standard freien Energien des Austausches (ΔG°CaMg = 238 cal/mol) sagten eine Bevorzugung für Ca in Montmorillonit und eine Bevorzugung für Mg in Vermiculit (ΔG°CaMg = − 1665 cal/mol) voraus. Die vorausgesagten thermodynamischen Gleichgewichtskonstanten waren vereinbar mit dem, experimentell bestimmten Selektivitätskoeffizienten KCaMg = 0,67, verglichen mit KsCaMg = 0,68 bei Montmorillonit, gleichbleibend über den gesamten Bereich der Mg-Sättigung, und KCaMg = 16,7 verglichen mit KsCaMg = 13,9 in Vermiculit bei 95% Mg Sättigung. Für die Aktivitätskoeffizienten von Ca und Mg Gegenionen in Montmorillonit wurden Werte von fCa̅ = 2,0 × 10-3 und fMg̅ = 2,2 × 10-3 festgestellt, die konstant blieben. Die Aktivitätskoeffizienten von austauschbarem Ca und Mg in Vermiculit ergaben sich als fCa̅ = 7,1 × 10-5 und fMg̅ = 3,5 × 10-5 bei einer äquivalenten Einheitsfraktion. Der Aktivitätskoeffizient von austauschbarem Mg nahm mit abnehmender Sättigung an Mg zu, und ergab sich im Bereich der niedrigen Mg Sättigung als 1,7 × 10-3. Das Mikrogefüge, der isomorphe Ersatz und die Oberflächenladungsdichte gaben Einsicht in die Veränderungen, die in den Aktivitätskoeffizienten von Gegenionen stattfinden.
Резюме
—Проведено экспериментальное определение изотермы обмена Ca-Mg в монтмориллоните. Вычислен коэффициент селективности этого обмена для широкой области насыщения Mg, который оказался постоянным. Значения стандартной свободной энергии замещения, константы термодинамического равновесия и коэффициенты активности обменных ионов Ca и Mg в вермикулите и монтмориллоните были предсказаны по данным о микроструктуре этих двух глин при предположении, что кулоновские силы играют основную роль во взаимодействии между пограничными ионами и заряженной поверхностью глины. Значения стандартной свободной энергии замещения (ΔG°CaMg = 238 кал/моль) указывали на предпочтительную связь Ca в монтмориллоните и Mg в вермикулите (ΔG°CaMg = -1665 кал/моль). Предсказанные константы термодинамического равновесия согласовались с экспериментально определенными коэффициентами селективности KCaMg = 0,67 по сравнению с KsCaMg = 0,68 для монтмориллонита (коэффициент оставался постоянным для всей области насыщения Mg) и KCaMg = 16,7 по сравнению с KsCaMg = 13,9 для вермикулита (при 95 % насыщения Mg). Найдены коэффициенты активности пограничных ионов Ca и Mg в монтмориллоните (fCa̅ = 2,0 × 10-3 и fMg̅ = 2,2 × 10-3 соответственно), которые остаются постоянными.
Получены коэффициенты активности обмменных ионов Ca и Mg в вермикулите (fCa̅ = 7,1 × 10-5 и/Mg = 3,5 × 10-5 соответственно, в эквивалентных долях единицы. Коэффициент активности обменного Mg увеличивается при уменьшении насыщении Mg; в области низкого насыщения Mg он равен 1,7 × 1,10-3. Микроструктура, изомофные замещения и поверхностная плотность заряда позволяют понять изменения коэффициентов активности пограничных ионов.
- Type
- Research Article
- Information
- Copyright
- Copyright © 1972, The Clay Minerals Society
Footnotes
Contribution from the Volcani Institute of Agricultural Research, Bet Dagan, Israel, 1971 Series No. 1911-E.
References
- 34
- Cited by


